POLIMERIZACIÓN POR ADICIÓN.
La polimerización por adición puede transcurrir a través de un mecanismo, en el que se formen radicales libres como especies intermedias en el curso de la reacción. En otros casos, la polimerización por adición tiene lugar mediante la formación de iones: carbocationes o carbaniones.
En ambos casos, polimerización por adición radicalar y polimerización por adición iónica, la reacción transcurre a través de tres
etapas:
-Iniciación: En esta etapa se forman los monómeros activados.
-Propagación: En esta etapa de la reacción se forma la cadena activada.
-Terminación: Esta fase se caracteriza por la pérdida de actividad y
producción del polímero.
Las alquenos son compuestos orgánicos hidrocarbonados que contienen uno o mas dobles enlaces en su estructura.

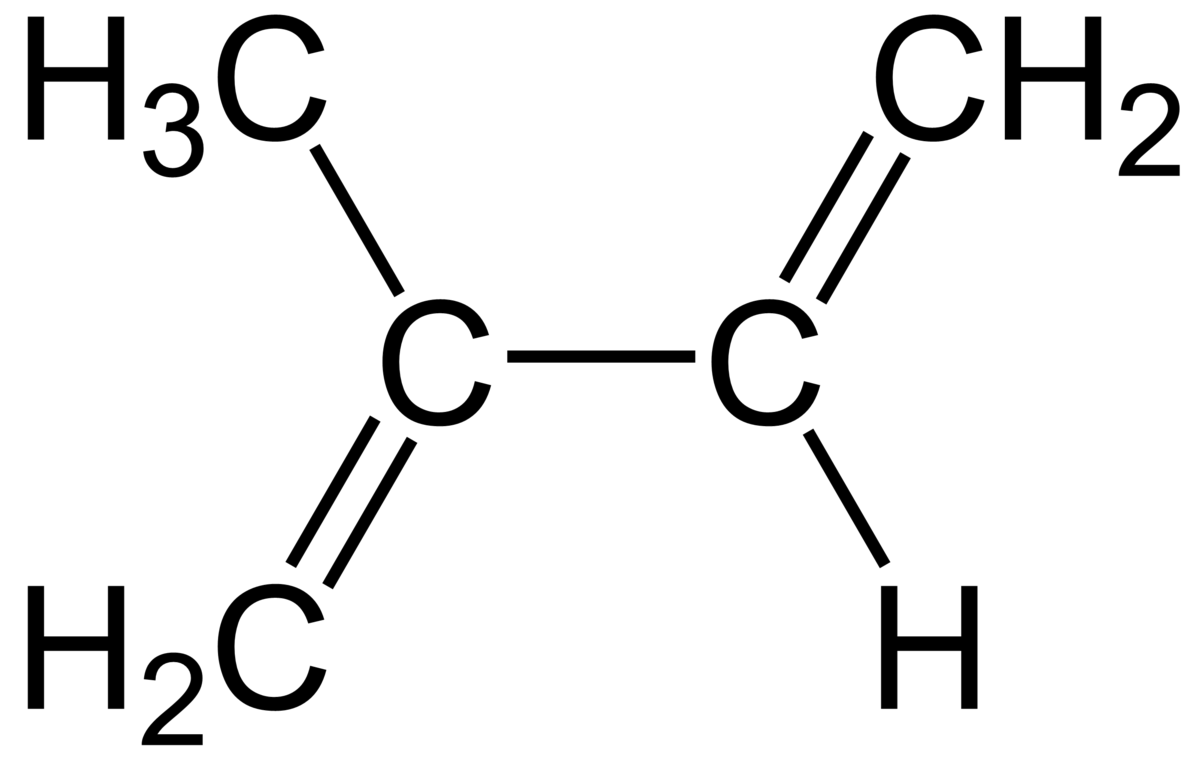
Cuando se presentan dos dobles enlaces se denominan dienos, cuando estos se encuentran separados por un enlace simple se denominan dienos conjugados.
La presencia del doble enlace, determina las propiedades y reactividad de los alquenos y dienos, entre las muchas reacciones que pueden experimentar se encuentra la polimerización que da lugar a cadenas de gran peso molecular llamadas macromoléculas, formadas por el enlace covalente entre moléculas pequeñas llamadas monómeros.
Cuando la polimerización tiene lugar entre monómeros distintos se obtienen copolímeros como el ABS (acrilonitrilo butadieno estireno)
En la tabla podemos observar, el mecanismo de polimerización por adición más adecuado, para los polímeros más comúnes.

POLIMERIZACIÓN POR ADICIÓN RADICALAR.
La polimerización por adición radicalar transcurre a través de tres etapas: Iniciación, propagación y terminación, perfectamente diferenciadas, siendo la etapa de iniciación la que necesita mayor energía de activación.
Iniciación.
La etapa de iniciación es la etapa en la que se van a crear los radicales libres. La formación de dichos radicales puede producirse de varias
formas:
-Por acción del calor.
-Por acción fotoquímica.
-Por acción de compuestos productores de radicales libres.
Esta última forma de iniciación es la más utilizada. Los iniciadores deben ser compuestos relativamente inestables que fácilmente puedan dar lugar a radicales libres.
La iniciación consiste entonces en la ruptura homolítica del iniciador, para formar radicales libres por efecto térmico.

La acción del radical libre sobre el monómero da lugar a la formación de un monómero activado, RM•, que vamos a representar por M*.
![]()
Ejemplos de iniciadores radicalares:
Peróxidos: El persulfato potásico (peróxido inorgánico) se rompe homoliticamente para dar dos radicales libres:
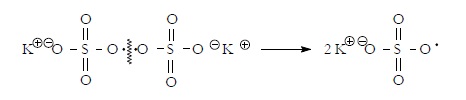

Hidroperóxidos. Los hidroperóxidos suelen necesitar un agente reductor que active su ruptura homolítica.
Por ejemplo, un hidroperóxido de alquilo, en presencia de Fe2+, se descompone según la reacción:
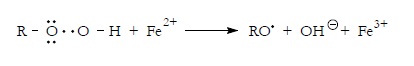
Peróxido de hidrógeno. El peróxido de hidrógeno en presencia de Fe2+ se rompe homoliticamente dando un radical hidroxilo:

Azocompuestos.
El radical formado por la ruptura homolítica del iniciador, que vamos a representar por R•, ataca al monómero que puede ser, por ejemplo, un compuesto vinílico.
donde si:
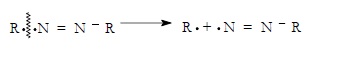
El radical formado por la ruptura homolítica del iniciador, que vamos a representar por R•, ataca al monómero que puede ser, por ejemplo, un compuesto vinílico.

El radical R• puede atacar en dos posiciones al monómero: en la posición (1) y en la posición (2), dando dos radicales. La reacción transcurrirá preferentemente hacía la formación del radical más estable:

Si comparamos la estabilidad relativa de los radicales (1) y (2), el radical (1) es un radical primario mientras que el radical (2) es secundario, luego el más estable es este último y, por consiguiente, el que tiene mayor probabilidad de formarse.
Propagación.
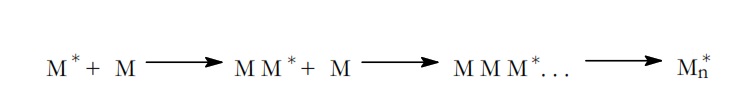
En la etapa de propagación, el radical o monómero activado, M*,que se ha formado en la etapa de iniciación se van adicionando los monómeros:
Al final de la etapa se obtiene la cadena activada Mn*.
La energía de activación necesaria para la etapa de propagación es de unas 7000 cal/mol por lo que la secuencia de las adiciones es muy rápida. Puede ser de unas milésimas de segundo.
La adición del monómero activado al monómero existente en el medio de la reacción puede tener varias posibilidades. Si volvemos al ejemplo de polimerización vinílica que estamos considerando, el monómero activado se puede adicionar al monómero en dos posiciones. La posición (1) que sería una adición cabeza–cabeza o la posición (2) que sería una adición cabeza–cola.
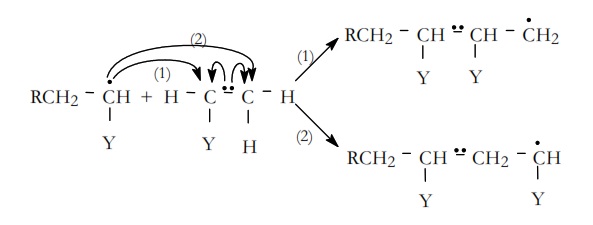
La etapa transcurrirá preferentemente hacia la formación del radical más estable. Si comparamos la estabilidad de los radicales (1) y (2), el radical (1) es un radical primario mientras que el radical (2) es un radical secundario, luego el sentido más probable de la reacción es el (2).
Terminación.
En la etapa de terminación o cierre se obtiene el polímero, por pérdida de actividad de las cadenas activadas que se han ido formando durante la etapa de propagación. La terminación se puede producir en cualquier momento. Generalmente tiene lugar cuando aumenta la viscosidad, ya que entonces hay un exceso de resto polimérico frente a monómero.
Posibles mecanismos de terminación:
Apareamiento.
Desproporción.
Transferencia de cadena.
Terminación por apareamiento.

Dos cadenas activadas se adicionan entre sí con pérdida de actividad.
Un ejemplo de terminación por apareamiento podría ser el siguiente:
 donde Rp es el resto polimérico.
donde Rp es el resto polimérico.
Terminación por desproporción.
Entre dos cadenas activas, iguales o distintas, puede producirse un proceso de desproporción obteniéndose al final dos cadenas distintas:

Por ejemplo, si consideramos dos cadenas:

Transferencia de cadena.
La etapa de terminación puede desarrollarse mediante un mecanismo de transferencia de cadena que puede tener lugar:
Entre la cadena activa que se ha formado en la etapa anterior y un monómero:

Entre la cadena activa y el polímero:
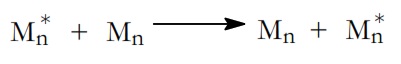
Entre la cadena activa y un reactivo T que vamos a llamar agente de transferencia:

El agente de transferencia permite terminar la polimerización cuando interese, es decir, regular el peso molecular medio del polímero sin necesidad de eliminar el iniciador. El reactivo T puede ser un retardador del crecimiento de la cadena o un inhibidor.
Es un retardador si T* comienza la formación de una nueva cadena:

Pero si en lugar de reaccionar con un monómero T* hubiera reaccionado consigo mismo para dar un producto inerte, sería un inhibidor:
![]()
El inhibidor termina totalmente la polimerización, mientras que el retardador termina la cadena pero no el proceso de polimerización.
POLIMERIZACIÓN POR ADICIÓN IÓNICA.
Algunas reacciones de polimerización por adición presentan una velocidad de reacción elevada, que no se puede justificar mediante un mecanismo de radicales libres. Para estas reacciones se ha propuesto un mecanismo que transcurre a través de la formación de iones, como especies intermedias, durante el curso de la reacción.
Estos iones pueden ser positivos (iones carbonio o carbocationes) o negativos (carbaniones). De esta manera existen dos tipos de polimerización
iónica: catiónica y aniónica.
POLIMERIZACIÓN CATIÓNICA.
Iniciación.
Los iniciadores de la polimerización catiónica son reactivos electrofílicos E+ que se incorporan al monómero M para dar un ión carbonio ME+:
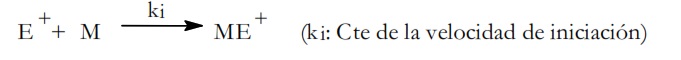
Los iniciadores catiónicos han de ser por tanto especies afines por los centros de elevada densidad electrónica, como son los ácidos fuertes o compuestos del tipo de los catalizadores de Friedel Crafts.
En la mayor parte de las polimerizaciones catiónicas donde interviene los catalizadores de Friedel y Crafts se necesita un cocatalizador o promotor, que ayuda a que la separación de cargas se verifique con mayor energía.
Por ejemplo, en el caso de la polimerización catiónica del isobutileno, la etapa de iniciación se realiza a partir de un iniciadorque es el BF3 (catalizador de Friedel y Crafts) y un promotor que es el agua. Entre el iniciador y el promotor se forma un ácido complejo,
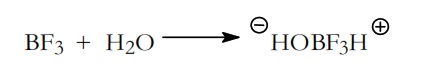
A continuación, el H+ procedente del ácido complejo es la especie electrofílica que se adiciona a el monómero. Esta incorporación puede ser en dos posiciones (1) ó(2) formándose dos iones carbonio. La etapa transcurrirá preferentemente hacia la formación del ión más estable:
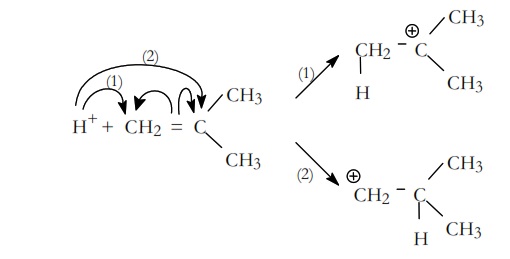
Si comparamos la estabilidad del ión (1) y del ión (2), el (1) es un ión terciario mientras que el (2) es primario, luego el ión (1) es más estable y el que tiene más probabilidad de formarse.
Los iones carbonio que se forman como especies intermedias no existirán como especies libres, ya que estarán asociados con la parte aniónica o contraión del reactivo durante todas las etapas de la polimerización. En nuestro caso el contraión será – HOBF3 que acompañará al ión t-butilo (CH3)3C+ durante su crecimiento.
Propagación.
En la etapa de propagación el ión carbonio que se ha formado en la etapa anterior y que, esquemáticamente, podemos representar por ME+ se va adicionando con las moléculas del monómero,
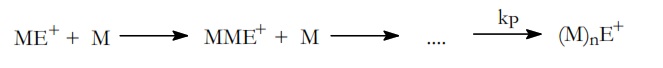
Siendo kp la constante de velocidad de la etapa de propagación.
En el ejemplo que estamos considerando, la polimerización del isobutileno, la etapa de propagación transcurre de la siguiente manera:
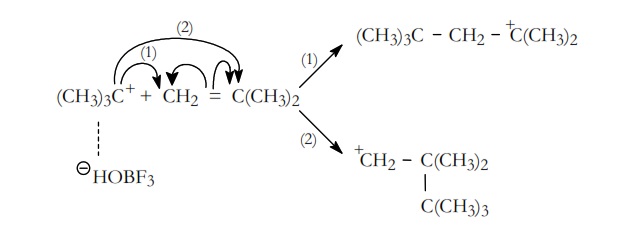
El ión t–butilo que se ha formado en la etapa de iniciación se adiciona a una nueva molécula de monómero, adición que puede ser en dos posiciones, dando lugar a los iones carbonio(1) y (2),
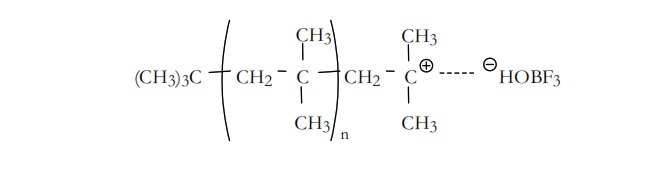
La reacción transcurrirá preferentemente hacia la obtención de ión más estable, en este caso el ión (1) que es un ión terciario.
Adiciones sucesivas irán aumentando la longitud de la cadena,
Terminación
La etapa de terminación se caracteriza por la pérdida de un protón por la macromolécula, ión procedente de la etapa anterior. De esta manera se obtiene el polímero, en nuestro ejemplo el polisobutileno, y se recupera el catalizador,

En este tipo de polimerización el catalizador actúa como tal, ya que no se consume en la polimerización. Sin embargo, en la polimerización por radicales libres el compuesto productor de radicales libres queda formando parte del polímero, y por tanto actúa realmente como un iniciador.
Por otra parte, el grado de polimerización del polímero así obtenido dependerá de la relación entre las constantes de velocidad de la etapa de propagación kp y de la etapa de terminación kt, es decir, depende de kp/kt.
Para la polimerización nos interesa que kp/kt mucho mayor que cero, pero hay procesos industriales que buscan la formación de dímeros, trímeros y tetrámeros a partir de una kt elevada.
Por ejemplo, con H2SO4 al 60 % y a unos 70 ºC se puede conseguir únicamente dimerizar el isobutileno.
POLIMERIZACIÓN ANIÓNICA.
Iniciación.
Los iniciadores de la polimerización aniónica son reactivos nucleofílicos N(–), que se incorporan al monómero M para dar un carbanión MN(–),
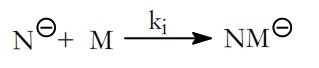
ki es la constante de la velocidad de la etapa de iniciación.
Los iniciadores aniónicos han de ser especies afines por los centros de baja densidad electrónica. Los compuestos no saturados, debido a la especial movilidad de los electrones π que forman sus enlaces múltiples, son especies nucleofílicasy no son monómeros adecuados para la polimerización aniónica.
Por tanto, compuestos de tipo vinílico como etileno o cloruro de vinilo son más aptos para una polimerización de tipo catiónico. Si estos compuestos tienen algún grupo sustituyente capaz de atraer electrones, pueden polimerizarse aniónicamente.
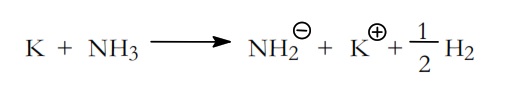
Entre los iniciadores aniónicos se encuentran las bases con los metales alcalinos cuyo carácter nucleofílico varia en el siguiente orden: Litio+ > Sodio +> Potasio +.
Por ejemplo, el potasio en amoniaco líquido da lugar al anión amiduro,
El anión amiduro es la especie nucleofílica que se incorpora al monómero, que puede ser el estireno, para dar el carbanión correspondiente,
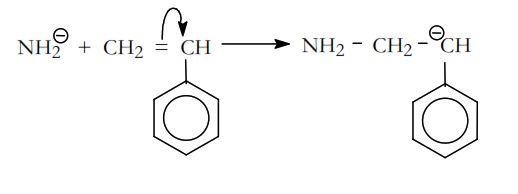
En el estireno, los electrones π del grupo vinilo se desplazan hacia el núcleo bencenico por un efecto E+ y esta influencia electrónica es trasmitida por los electrones π deslocalizados del anillo de una parte a otra del núcleo. Por ello, la densidad electrónica del grupo CH2=CH– disminuye y es posible la incorporación del iniciador aniónico.
Se consigue una mayor reactividad del estireno si se incrementa la polaridad del disolvente y el carácter metálico del metal.
Propagación.
En la etapa de propagación, el carbanión que se ha formado en la etapa anterior, y que esquemáticamente vamos a representar por NM(–) se va adicionando con las moléculas del monómero,
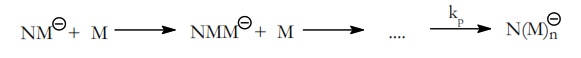
kp es la constante de velocidad de propagación.
En el ejemplo que estamos considerando la polimerización del estireno,
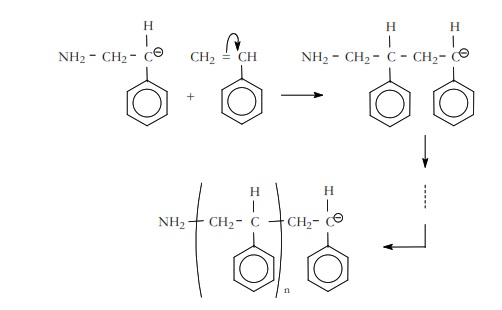
Al final de esta etapa obtendríamos el macrocarbanión representado.
Terminación.
El crecimiento de la cadena puede terminar tomando un protón del disolvente, que en el caso del estireno es el amoniaco,
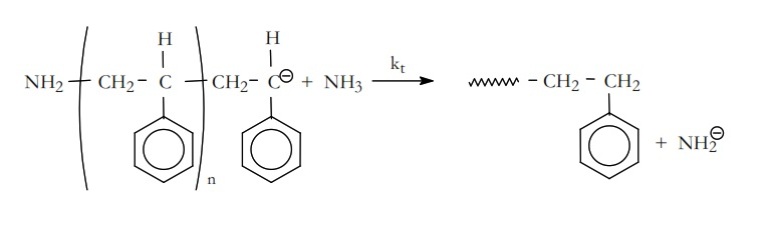
Kt es la constante de velocidad de la etapa de terminación.
PRINCIPALES POLIMEROS DE ADICIÓN.
PVC, policloruro de vinilo, usado en tuberias hidraúlicas, imitaciones de piel, pvc laminado etc.
Polipropileno, tiene varios usos en embalaje, fabricación de cuerdas, muebles, articulos de papeleria etc.
Poliestireno, es usado en la fabricación de platos y vasos desechables, se usa en la industria del empaque y embalaje, envases de yogurth, cajas de CD, entre otros.
Politetrafloruroetileno, tiene varias aplicaciones: En revestimientos de aviones, cohetes y naves espaciales debido a las grandes diferencias de temperatura que es capaz de soportar, recubrimiento de sartenes, en la medicina ya que no recciona con tejidos, en estructuras como protección anticorrosiva.
Policloruro de Vilideno,mejor conocido como Saran, se usa para el recubrimiento de alimentos, aunque en 2004 se cambio su uso por el pelietileno de baja densidad, ya que el saran contiene cloro en su estructura.
Poliacrilonitirilo,sus nombres comerciales son: Orlon, Acrilan y Creslan, se usa como fibra para textiles, alfombras y tapiceria.
Acetato de polivinilo; tiene su uso principal es como adhesivo, es comunmente utilizado por los carpinteros en la fabricación de muebles.
Alcohol polivinílico, se usa como materia prima para fabricar otros polímeros,se usa como espesante en las formulaciones de acetato de polivinilo, Juguete para niños cuando se combina con bórax forma un producto gelatinoso viscoso que escurre, excipinente de algunos medicamentos de uso tópico, en la industria del empaque como película soluble , se usa para fabricar la fibras de de vinialon, entre otos usos.
Polimetil metacrilato, conocido como: plexiglass o lucite,tiene resistencia a la intemperie, transparencia y resistencia al rayado.
Por estas cualidades es utilizado en la industria del automóvil como el faro del coche, iluminación, cosméticos, espectáculos, construcción y óptica, entre muchas otras. En el mundo de la medicina se utiliza la resina de polimetilmetacrilato para la fabricación de prótesis óseas y dentales y como aditivo en polvo en la formulación de muchas de las pastillas que podemos tomar por vía oral. En este caso actúa como retardante a la acción del medicamento para que esta sea progresiva.
Algunos elástomeros se polimerizan por adición como: El polisopreno, el polibutadieno, el policloropreno, mejor conocido como neopreno.

Francisco Javier Liera R. pliera@hotmail.com
Bibliografia
Ma. del Carmen Clemente Jul. (2010). Procesos de Polimerización. Noviembre 2017, de Universidad Politécnica de Madrid Sitio web: http://ocw.upm.es/ingenieria-quimica/quimica-de-combustibles-y-polimeros/Contenidos/Material_de_clase/qcyp-b5.pdf
Wikypedia. (2017). Polimerizacion por Adicion. 20 de Octubre 2017, de Fundación Wikimedia, Inc.
sciencetuts. (2017). Types of polymerization. 15 de octubre 2017, de 7activestudio.com Sitio web: http://www.sciencetuts.com/subjects/polymers/course.
Mariano . (2013). Polimerización. Octubre 2017, de Blogger Sitio web: http://tecnologiadelosplasticos.blogspot.mx/2013/07/polimerizacion.html

